A principios del siglo XX fue un momento muy propicio para las ciencias. Además de que Ernest Rutherford y Niels Bohr dieron a luz al Modelo Estándar de física de partículas, también fue un período de avances en el campo de la mecánica cuántica. Gracias a los estudios en curso sobre el comportamiento de los electrones, los científicos comenzaron a proponer teorías mediante las cuales estas partículas elementales se comportaron de manera que desafiaron la física clásica y newtoniana.
Un ejemplo de ello es el modelo de nube de electrones propuesto por Erwin Schrodinger. Gracias a este modelo, los electrones ya no se representan como partículas que se mueven alrededor de un núcleo central en una órbita fija. En cambio, Schrodinger propuso un modelo por el cual los científicos solo podían hacer conjeturas educadas sobre las posiciones de los electrones. Por lo tanto, sus ubicaciones solo podrían describirse como parte de una "nube" alrededor del núcleo donde es probable que se encuentren los electrones.
Física atómica hasta el siglo XX:
Los primeros ejemplos conocidos de teoría atómica provienen de la antigua Grecia y la India, donde filósofos como Demócrito postularon que toda la materia estaba compuesta de unidades diminutas, indivisibles e indestructibles. El término "átomo" fue acuñado en la antigua Grecia y dio origen a la escuela de pensamiento conocida como "atomismo". Sin embargo, esta teoría era más un concepto filosófico que científico.
No fue sino hasta el siglo XIX que la teoría de los átomos se articuló como una cuestión científica, con los primeros experimentos basados en evidencia que se llevaron a cabo. Por ejemplo, a principios de 1800, el científico inglés John Dalton utilizó el concepto del átomo para explicar por qué los elementos químicos reaccionaron de ciertas maneras observables y predecibles. A través de una serie de experimentos con gases, Dalton desarrolló lo que se conoce como la teoría atómica de Dalton.
Esta teoría se expandió sobre las leyes de conversación de masas y proporciones definidas y se redujo a cinco premisas: los elementos, en su estado más puro, consisten en partículas llamadas átomos; los átomos de un elemento específico son todos iguales, hasta el último átomo; los átomos de diferentes elementos pueden distinguirse por sus pesos atómicos; átomos de elementos se unen para formar compuestos químicos; los átomos no se pueden crear ni destruir en una reacción química, solo cambia la agrupación.
Descubrimiento del electrón:
A fines del siglo XIX, los científicos también comenzaron a teorizar que el átomo estaba formado por más de una unidad fundamental. Sin embargo, la mayoría de los científicos se aventuraron a que esta unidad sería del tamaño del átomo más pequeño conocido: el hidrógeno. A finales del siglo XIX, el suyo cambiaría drásticamente, gracias a la investigación realizada por científicos como Sir Joseph John Thomson.
A través de una serie de experimentos con tubos de rayos catódicos (conocidos como el tubo de Crookes), Thomson observó que los rayos catódicos podrían ser desviados por campos eléctricos y magnéticos. Llegó a la conclusión de que, en lugar de estar compuestos de luz, estaban formados por partículas cargadas negativamente que eran mil veces más pequeñas y 1800 veces más ligeras que el hidrógeno.

Esto efectivamente refutó la noción de que el átomo de hidrógeno era la unidad más pequeña de materia, y Thompson fue más allá al sugerir que los átomos eran divisibles. Para explicar la carga general del átomo, que consistía en cargas positivas y negativas, Thompson propuso un modelo mediante el cual los "corpúsculos" cargados negativamente se distribuían en un mar uniforme de carga positiva, conocido como el Modelo de pudín de ciruela.
Estos corpúsculos se llamarían más tarde "electrones", basados en la partícula teórica predicha por el físico angloirlandés George Johnstone Stoney en 1874. Y de esto, nació el Modelo de pudín de ciruela, llamado así porque se parecía mucho al desierto inglés que consiste en pastel de ciruela y pasas. El concepto fue introducido al mundo en la edición de marzo de 1904 del Reino Unido. Revista filosófica, con gran aclamación.
Desarrollo del modelo estándar:
Experimentos posteriores revelaron una serie de problemas científicos con el modelo Plum Pudding. Para empezar, existía el problema de demostrar que el átomo poseía una carga de fondo positiva uniforme, que se conoció como el "Problema de Thomson". Cinco años después, el modelo sería refutado por Hans Geiger y Ernest Marsden, quienes realizaron una serie de experimentos utilizando partículas alfa y lámina de oro, también conocido como. el "experimento de la lámina de oro".
En este experimento, Geiger y Marsden midieron el patrón de dispersión de las partículas alfa con una pantalla fluorescente. Si el modelo de Thomson fuera correcto, las partículas alfa pasarían sin obstáculos a través de la estructura atómica de la lámina. Sin embargo, notaron que, si bien la mayoría se disparó directamente, algunos de ellos se dispersaron en varias direcciones, y algunos retrocedieron en la dirección de la fuente.

Geiger y Marsden concluyeron que las partículas habían encontrado una fuerza electrostática mucho mayor que la permitida por el modelo de Thomson. Dado que las partículas alfa son solo núcleos de helio (que están cargados positivamente), esto implicaba que la carga positiva en el átomo no estaba ampliamente dispersa, sino que se concentraba en un pequeño volumen. Además, el hecho de que esas partículas que no se desviaron pasaran sin obstáculos significaba que estos espacios positivos estaban separados por vastos abismos de espacio vacío.
Para 1911, el físico Ernest Rutherford interpretó los experimentos de Geiger-Marsden y rechazó el modelo del átomo de Thomson. En cambio, propuso un modelo en el que el átomo consistía en su mayoría en un espacio vacío, con toda su carga positiva concentrada en su centro en un volumen muy pequeño, que estaba rodeado por una nube de electrones. Esto se conoció como el Modelo Rutherford del átomo.
Los experimentos posteriores de Antonius Van den Broek y Niels Bohr refinaron aún más el modelo. Mientras que Van den Broek sugirió que el número atómico de un elemento es muy similar a su carga nuclear, este último propuso un modelo del átomo similar al Sistema Solar, donde un núcleo contiene el número atómico de carga positiva y está rodeado por un igual número de electrones en capas orbitales (también conocido como el modelo de Bohr).
El modelo de nube de electrones:
Durante la década de 1920, el físico austriaco Erwin Schrodinger quedó fascinado por las teorías Max Planck, Albert Einstein, Niels Bohr, Arnold Sommerfeld y otros físicos. Durante este tiempo, también se involucró en los campos de la teoría atómica y los espectros, investigando en la Universidad de Zúrich y luego en la Universidad Friedrich Wilhelm de Berlín (donde sucedió a Planck en 1927).

En 1926, Schrödinger abordó el tema de las funciones de onda y los electrones en una serie de documentos. Además de describir lo que se conocería como la ecuación de Schrodinger, una ecuación diferencial parcial que describe cómo cambia el estado cuántico de un sistema cuántico con el tiempo, también utilizó ecuaciones matemáticas para describir la probabilidad de encontrar un electrón en una determinada posición. .
Esto se convirtió en la base de lo que se conocería como el Modelo de Nube de Electrones (o mecánica cuántica), así como la ecuación de Schrodinger. Basado en la teoría cuántica, que establece que toda la materia tiene propiedades asociadas con una función de onda, el modelo de nube de electrones difiere del modelo de Bohr en que no define la ruta exacta de un electrón.
En cambio, predice la posición probable de la ubicación del electrón en función de una función de probabilidades. La función de probabilidad básicamente describe una región similar a una nube donde es probable que se encuentre el electrón, de ahí el nombre. Donde la nube es más densa, la probabilidad de encontrar el electrón es mayor; y donde es menos probable que esté el electrón, la nube es menos densa.
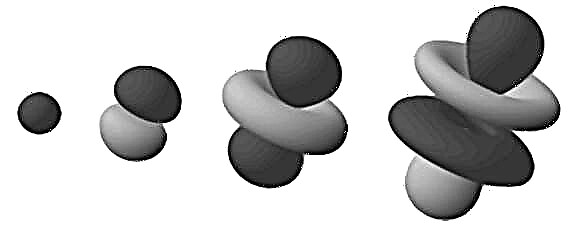
Estas regiones densas se conocen como "orbitales de electrones", ya que son el lugar más probable donde se encontrará un electrón en órbita. Extendiendo este modelo de "nube" a un espacio tridimensional, vemos una barra o un átomo en forma de flor (como en la imagen en la parte superior). Aquí, las regiones de ramificación son aquellas donde es más probable que encontremos los electrones.
Gracias al trabajo de Schrodinger, los científicos comenzaron a comprender que, en el ámbito de la mecánica cuántica, era imposible saber la posición exacta y el momento de un electrón al mismo tiempo. Independientemente de lo que el observador sepa inicialmente sobre una partícula, solo puede predecir su ubicación o momento sucesivo en términos de probabilidades.
En ningún momento podrán determinar ninguno de los dos. De hecho, cuanto más sepan sobre el impulso de una partícula, menos sabrán sobre su ubicación, y viceversa. Esto es lo que hoy se conoce como el "Principio de incertidumbre".
Tenga en cuenta que los orbitales mencionados en el párrafo anterior están formados por un átomo de hidrógeno (es decir, con un solo electrón). Cuando se trata de átomos que tienen más electrones, las regiones orbitales de electrones se distribuyen uniformemente en una bola esférica difusa. Aquí es donde el término "nube de electrones" es más apropiado.
Esta contribución fue reconocida universalmente como una de las contribuciones de costo importante del siglo XX, y una que desencadenó una revolución en los campos de la física, la mecánica cuántica y, de hecho, todas las ciencias. A partir de entonces, los científicos ya no estaban trabajando en un universo caracterizado por absolutos de tiempo y espacio, ¡sino en incertidumbres cuánticas y relatividad tiempo-espacio!
Hemos escrito muchos artículos interesantes sobre átomos y modelos atómicos aquí en la revista Space. Aquí está ¿Cuál es el modelo atómico de John Dalton ?, ¿cuál es el modelo de pudín de ciruela ?, ¿cuál es el modelo atómico de Bohr ?, ¿quién fue Demócrito ?, y ¿cuáles son las partes de un átomo?
Para obtener más información, asegúrese de verificar ¿Qué es la mecánica cuántica? de Live Science.
Astronomy Cast también tiene episodios sobre el tema, como Episodio 130: Radio Astronomía, Episodio 138: Mecánica cuántica y Episodio 252: Principio de incertidumbre de Heisenberg